



Az egyik létfontosságú elem. A légkör legnagyobb részét adja. Nélküle aligha volna élet a Földön. Íme a nitrogén és néhány érdekesség, amit érdemes tudni róla.
Mi a nitrogén?
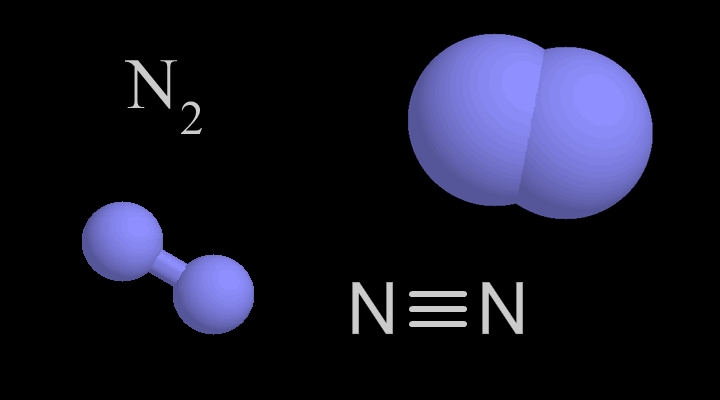
A nitrogén vegyjele N, rendszáma 7 (azaz a hetedik a periódusos rendszerben, és 7 proton található az atommagjában). Molekulaszerkezete N2, ahol a két nitrogénatomot háromszoros kötés tartja össze: |N ≡ N|. A nitrogént 1772-ben Daniel Rutherford, skót orvos fedezte fel, miután rájött arra, hogy a levegőből elkülöníthető.
A nitrogén tulajdonságai
A nitrogén elemi állapotában színtelen, szagtalan, íztelen és standard körülmények között többnyire inaktív kétatomos gáz, amely a Föld légkörének 78,09 térfogatszázalékát adja. Azaz minden lélegzetvételnél 1 liter levegővel gyakorlatilag 8 deciliter nitrogént lélegzünk be, illetve fújunk ki. A levegőn kívül rengeteg helyen megtaláljuk még, hiszen – becslések szerint – a világegyetem hetedik leggyakoribb eleme. Jelen van a földkéregben, a vízben oldva és számos élő szervezetben is. A nitrogén számos vegyületben, például nitrátokban és nitritekben is megtalálható, melyek fontosak a növények növekedése és az ökoszisztémák egészsége szempontjából. A nitrogén előfordul minden élő szervezetben, elsősorban az aminosavakban (így a fehérjékben), valamint a nukleinsavakban (a DNS-ben és az RNS-ben). Az emberi test mintegy 3 tömegszázalék nitrogént tartalmaz, ezzel az oxigén, a szén és a hidrogén után a negyedik leggyakoribb elem az emberi testben. Az elem mozgását a levegőből a bioszférába és a szerves vegyületekbe, majd onnan vissza a légkörbe a nitrogénciklus írja le.
A nitrogént számos területen alkalmazzák, az életben maradáshoz szükséges létfenntartó szerepén túl.
Folyékony nitrogén
A nitrogén már viszonylag alacsony hőfokon is gázneművé válik, ezért a folyékony halmazállapot eléréséhez rendkívül alacsony hőmérsékletre (-196 Celsius-fokra) hűtik le, majd sokszorosan szigetelt tárolókba töltik, méghozzá jó okkal: mert olcsó, gáz formájában (ha van mellette elég oxigén is, mert a tiszta nitrogén fulladást okozhat) az élőlényekre veszélytelen, kiváló hűtőközeg.
Földi körülmények között cseppfolyósításnak nevezett eljárással lehet elérni, melynek során a nitrogéngázt hőcserélők, kompresszorok és tágítók sorozatán vezetik át, hogy fokozatosan lehűtsék és összenyomják a gázt. A folyamat jellemzően több lépést és hűtési ciklusok kaszkádját foglalja magában a folyékony nitrogénhez szükséges alacsony hőmérséklet eléréséhez.
A folyékony nitrogént gyakorta alkalmazzák kriogén céllal, általában szupravezetők és más anyagok rendkívül alacsony hőmérsékletre hűtésére. A nitrogént biológiai minták, például vér- és szövetminták alacsony hőmérsékleten történő tartósítására és ebből fakadóan élelmiszer tartósítására, valamint hűtőközegként is használják a különféle hűtőrendszerekben. Az orvostudományban a folyékony nitrogént krioterápiára használják a bőrelváltozások, például a szemölcsök eltávolítására, valamint a rákot megelőző állapotú és rákos sejtek eltávolítására. A folyékony nitrogént fémek zsugorítására is alkalmazzák, a gyorsan lehűlő fém összehúzódását kihasználva.

Cseppfolyós nitrogén
A cseppfolyós nitrogén egy kriogén folyadék. Légköri nyomáson -195,8 Celsius-fokon forr. Ha megfelelő tartályban, adott esetben termoszban szigetelik el, jelentős párolgási veszteség nélkül szállítható.
A szárazjéghez hasonlóan, a folyékony nitrogént leginkább hűtőközegként használják. Többek között vér, reproduktív sejtek (sperma és petesejt), illetve egyéb biológiai minták és anyagok krioprezervációjára megfelelő. A krioterápia során klinikailag a bőrön alkalmazzák azért, hogy eltávolítsák a cisztákat és a szemölcsöket. Bizonyos laboratóriumi berendezésekben, a hidegcsapdákban használják, illetve röntgendetektorok vagy infravörös érzékelők hűtésére is alkalmazzák. Ezenkívül az órajelnél gyorsabban működtetett számítógépek központi feldolgozóegységeinek és egyéb eszközeinek hűtésére, melyek a normál működésnél több hőt termelnek.
Nitrogéngáz
A nitrogéngázt számos területen alkalmazzák. Ide sorolandó az inert atmoszféra előállítása, amely tisztán vagy szén-dioxiddal keverve megőrzi a csomagolt, illetve az ömlesztett élelmiszerek frissességét (késlelteti az avasodást és más oxidatív károsodásokat). A tiszta nitrogént mint élelmiszer-adalékanyagot az Európai Unió az E941-es E-számmal jelöli. A nitrogéngázt a hagyományos izzólámpákban is felhasználják az argon olcsó alternatívájaként. Elektronikus alkatrészek gyártásához is kiváló, mint amilyenek a tranzisztorok, a diódák és az integrált áramkörök. Szárítva és nyomás alá helyezve, dielektrikumgázként is használják nagyfeszültségű berendezésekben. A nitrogéngázt rozsdamentes acél gyártásához is felhasználják. Továbbá katonai repülőgépek üzemanyag-rendszerében is alkalmazzák, hogy csökkentsék a tűzveszélyt. A nitrogéngáz tűzveszélyes folyadékokkal töltött tartályok tetején biztonsági megoldásként (nitrogénpárna) is jellemző. Közúti és légi járművek gumiabroncsainak töltésére is alkalmas. Az üzemelés körülményei között nem cseppfolyósodó inert gáztöltetként, például légrugókban, tűzoltópalackokban is hasznos lehet.
Ammóniagyártás
Az ammónia vagy régies nevén légköneg nitrogén és hidrogén vegyülete, képlete NH3. Normál állapotban jellegzetes szúrós szagú, gáz-halmazállapotú anyag, maró és mérgező hatású. Az ammónia a salétromsavval együtt a legrégebben ismert, legelterjedtebb és legfontosabb nitrogénvegyületek közé tartozik.

A ammónia – előállítását illetően – elemeiből, a hidrogénből és a nitrogénből szintézis útján keletkezik, valamint a bomlás során számos nitrogéntartalmú vegyületből. A hidrogén és a nitrogén közönséges hőmérsékleten nem hatnak egymásra, de ha kifejlődésük pillanatában elegyednek, vagy ha elegyükön elektromos szikra csap át, valamint ha platinaháló hat rájuk, keletkezik egy kevés ammónia. Ilyen szintézises úton állította elő Fritz Haber karlsruhei tanár az ammóniát hidrogén- és nitrogéngázból nyomás alatt. Iparilag napjainkban is ehhez hasonló módszerrel állítják elő az ammóniát (Haber-Bosch-eljárás). A nitrogén oxidjai, valamint a salétromossav és a salétromsav – a fejlődő hidrogéntől vagy katalizátor (például platinaháló, réz-oxid, vas-oxid stb.) jelenlétében, a hidrogéngáztól – ammóniává redukálódnak. Az ammónia keletkezésének a legutóbbi módját ipari előállításakor értékesítik.
Hűtőközeg
A világ ipari hűtőberendezéseinek nagy része ammóniával működik. Az ammónia középnyomású hűtőközeg, ezért és kedvező termodinamikai tulajdonságainak köszönhetően általános hűtési célokra kiválóan alkalmas. Egyezményes jele: R717. Gyúlékonysága alacsony, a Föld légkörére nem ártalmas. Maró hatása miatt elővigyázatosan használandó. Az abszorpciós hűtőgépeknek szinte kizárólagos hűtőközege (ammónia-víz hűtőközegpárként).

A nitrogén nélkülözhetetlen építőköve az amino– és nukleinsavaknak, amelyek alapvető fontosságúak a földi élet számára.
Talaj
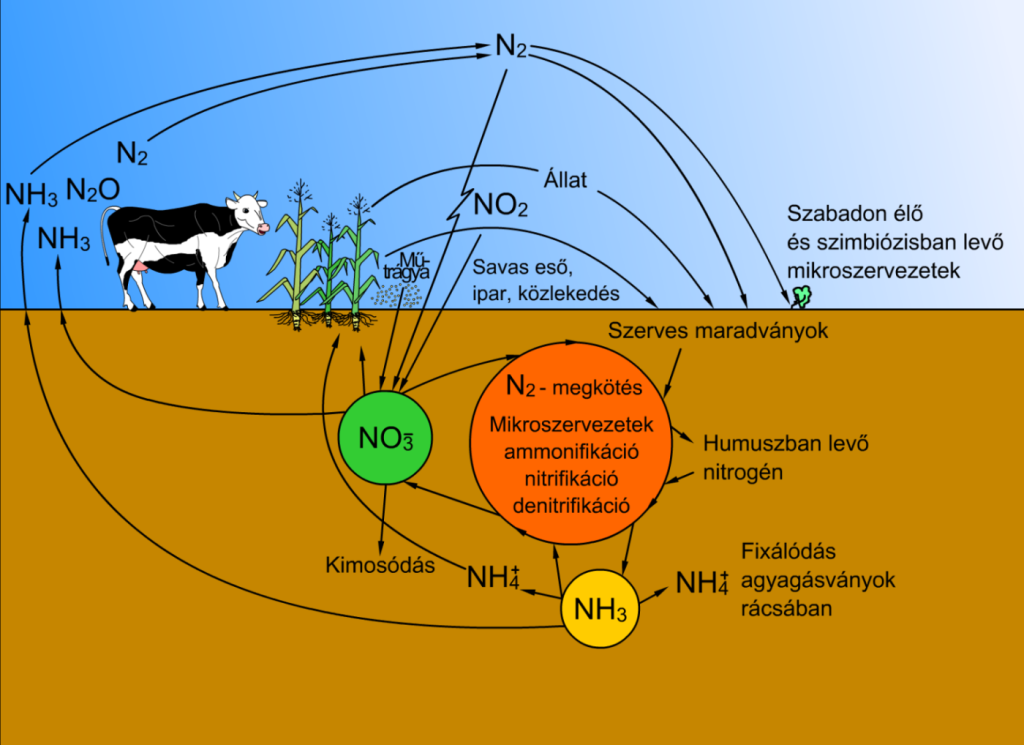
A légkörben lévő elemi nitrogént közvetlenül nem tudják felhasználni sem a növények, sem az állatok, ezért át kell alakítani (meg kell kötni) megfelelő állapotba, hogy hasznos legyen a magasabb rendű növények és állatok számára. A csapadék gyakran tartalmaz jelentős mennyiségű ammóniumiont és nitrátot, melyről azt gondolják, hogy a villámlás, illetve egyéb légköri elektromos jelenségek nitrogénmegkötésének az eredménye. Mivel azonban az erdő lombkoronája a légköri nitráthoz képest jobban megtartja az ammóniumionokat, a kötött nitrogén többsége nitrátként éri el a talaj felszínét a fák alatt. A fa gyökerei ezzel szemben előnyösebben asszimilálják a talajnitrátokat, mint a talajbeli ammóniumionokat.
Egyes különleges baktériumok (pl. a Rhizobium trifolii) rendelkeznek nitrogéngáz-enzimmel. Ammóniumion formájában megkötik a légköri nitrogént, így kémiailag hasznossá alakítják a magasabb rendű szervezetek számára. Ehhez a folyamathoz nagy mennyiségű energia és anoxiás körülmények szükségesek. Ezek a baktériumok képesek szabadon élni a talajban (pl. az Azotobacter), de általában szimbiotikus kapcsolatban élnek a hüvelyes növények – pl. a lóhere vagy a szójabab – gyökérgumóival. A nitrogénmegkötő baktériumok szintén szimbiózisban élnek számos független növényfajjal, például az égerrel, a zuzmókkal, a kazuárfával, májmohákkal és az óriáslapuval.
A szimbiotikus kapcsolat részeként a növény a megkötött ammóniumionokat nitrogén-oxidokká és aminosavakká alakítja, hogy fehérjéket és más molekulákat képezzen belőlük. Mindezért cserébe a növény cukrot juttat (szekretál) a szimbióta baktériumoknak. A hüvelyesek anaerob (oxigénmentes) környezetet tartanak fenn a nitrogénmegkötő baktériumok számára.
Növényi tápanyag
A növények képesek asszimilálni a nitrogént közvetlenül nitrátok formájában is, melyek jelen lehetnek a talajban természetes ásványok, műtrágyák, állati hulladék vagy szerves bomlástermékek (nem kifejezetten a növényhez kapcsolódó baktériumok termékeként) formájában. Az ilyen módon elnyelt nitrátok először nitritekké alakulnak a nitrát-reduktáz-enzim hatására, majd a nitrit-reduktáz-enzim ammóniává alakítja őket. Az organizmusok hulladékai és bomlástermékei előállítanak ugyan kis mennyiségű nitrátot, de a nitrogéntartalom nagy része végül molekuláris nitrogén formájában visszatér a légkörbe. A nitrogénciklus a nitrogén körforgása a légkörből az organizmusokba, majd onnan vissza.
A nitrogén a növények növekedéséhez nélkülözhetetlen tápanyag, ezért a nitrogénalapú műtrágyákat széles körben használják a terméshozam javítására. A nitrogénműtrágyák ammónium-nitrátból vagy karbamidból készülhetnek, de mindkettőhöz alapvetően nitrogéngáz szükséges.

A nitrogénalapú műtrágyák hatékonyak és jól használhatók a terméshozamok javításában, valamint az élelmiszer-termelés növelésében. Ennek fő oka a nitrogén már említett szerepe a természetben: éppen úgy elengedhetetlen anyag a növények növekedése során, mint a szén. Alapesetben – a nitrogénkörforgás révén – a termőtalajban folyamatosan megújul a nitrogéntartalom, így a növények újabb és újabb nemzedékei juthatnak elegendő mennyiséghez.
Eltekintve a természetben is előforduló különböző krízishelyzetektől (pl. aszálytól, árvíztől, talajeróziótól stb.), az intenzív, mélyszántásos, monokultúrás növénytermelés is durván rombolja a talaj termőképességét. Az ökológiai gazdálkodás szerepe többek között éppen emiatt értékelődik fel. Környezetbarát gazdálkodás hiányában azonban műtrágyázásra van szükség. Ilyen esetben a nitrogénalapú műtrágyák használata segíthet abban, hogy a növények elegendő nitrogénhez jussanak a növekedéshez és a bő terméshez.

A nitrogénalapú műtrágyák hatékonysága és felhasználhatósága azonban több tényezőtől is függ, például a talaj és a termény típusától, valamint a kijuttatás módjától is. A nitrogénalapú műtrágyák a nagy nitrogénigényű növények, többek között a kukorica, a búza és a rizs esetében a leghatékonyabbak. Egyes növények – például a hüvelyesek – azonban nem igényelnek túl sok nitrogént a talajban.
A nitrogén vegyületei robbanásveszélyesek lehetnek. Az ammóniaalapú műtrágya önmagában is robbanékony. Egy súlyos katasztrófa példája igazolja ezt, amely Bejrútban következett be 2020-ban, amikor közel 2750 tonna ammónia-nitrát-műtrágya robbant fel.
A műtrágyák szakszerű használatával elkerülhetjük környezetünk és természeti kincseink veszélyeztetését. A talajból a növények által kivont tápanyagok harmonikus, a talajtulajdonságokat maximálisan figyelembe vevő visszapótlásával megőrizhetjük és javíthatjuk is termőföldjeinket. Főként, ha a talajélet számára kedvező körülményeket teremtünk, ezzel hosszú távon fenntartva a termelés biztonságát.
Fotók: Canva